|
|
Физико-химические основы плавления льда и эффективность противогололедных реагентов
Скорость таяния льда зависит от толщины слоя, его однородности, от погодных условий. Толщина льда варьируется от едва видимой пленки, образованной при понижении температуры на мокрой поверхности дорожного покрытия, до толстого слоя льда, образованного при замерзании талой воды и снега. Химическая формула и воды, и льда ? Н2О, но структура воды и льда различается наличием водородных связей. Структура жидкой воды представляет собой нарушенный тепловым движением тетраэдрический каркас, пустоты которого частично заполнены молекулами воды. Такая структура называется льдоподобной. Каждая молекула воды в составе льдоподобного каркаса образует одну зеркально- симметричную (прочную) и три центрально-симметричные (менее прочные) связи. Первая относится к связи между молекулами воды соседних слоев и остальные к связям между молекулами одного слоя.
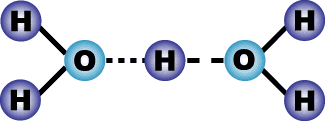
Молекула воды состоит из атомов водорода и кислорода, связанных между
собой химической ковалентной связью. В свою очередь молекулы воды взаимодействуют
друг с другом и связаны водородной связью, что придает воде плотность.
Чем больше водородных связей, тем выше плотность воды. Наибольшей плотностью
1 г/см3 вода обладает при температуре 4°С и нормальном давлении. Лед благодаря
пустотам в кристаллической решетке имеет плотность меньше плотности воды.
Удельная плотность льда равна 0,92 г/см3. Структуру воды можно представить
в виде формулы:
где - - - водородная связь (энергия связи О - - - Н 21 кДж/моль),
------ ковалентная (химическая) связь (энергия связи О------Н 456 кДж/моль)
Фазовое состояние воды зависит от количества в ее структуре водородных
связей. В случае, когда связи полностью разорваны, вода находится в парообразном
состоянии, при температуре 0°С разорванных водородных связей в жидкой
воде 15%, если разорванных связей нет, то вода находится в твердом состоянии
(лед).
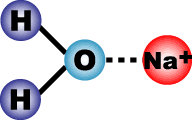
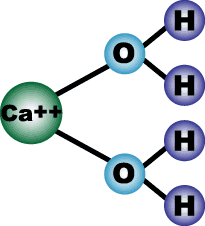
Вода является одним из самых распространенных растворителей. При растворении
солей (NaCl, CaCl2 и др.) в воде происходит сольватация ионов, т.е. электролитическая
диссоциация солей по уравнениям:
NaCl + вода -> Na+ + Cl -
CaCl2 + вода -> Ca++ + 2Cl -
Эти процессы сопровождаются тепловыми явлениями и протекают до наступления
динамического равновесия при данной температуре воздуха
Ионы кальция или натрия взаимодействуют с молекулами воды и занимают водородные
связи, так как ионы и кальция, и натрия более электроотрицательны, чем
ионы водорода. При этом нарушается структура воды (льда):
Рисунок 1.
 |
 |
На основании этого делается вывод, что хлористый кальций в два раза эффективнее, чем хлористый натрий при низких температурах. Здесь следует напомнить, что молекулярная масса хлористого натрия 58,5, а молекулярная масса хлористого кальция 111, и простой расчет показывает, что необходимые две молекулы NaCl равнозначны по расходу препарата одной молекуле CaCl2.
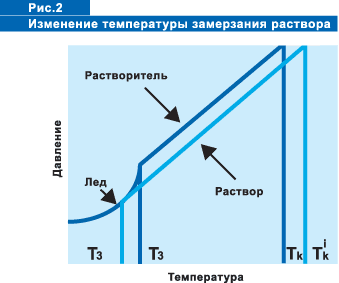
При растворении нелетучего вещества в воде относительное давление пара
воды над раствором уменьшается, что вызывает повышение температуры кипения
и понижение температуры замерзания по сравнению с чистой водой. Причем,
чем выше концентрация раствора, тем меньше упругость пара.
По закону Рауля в разбавленных растворах не электролитов при постоянной температуре понижение давления пара пропорционально количеству вещества, растворенного в данном весовом количестве растворителя.
Dtз = kз С, где С - концентрация, выраженная в числе молей, растворенных
в 1000 г растворителя, kз - коэффициент пропорциональности, зависящий
от природы растворителя, для воды kз = 1,86.
,
где M - молекулярная масса вещества,
m - масса вещества, г.
Следовательно, при растворении в 1000 г воды одного моля вещества, температура
замерзания снижается на 1,86°С. Закон Рауля применим только к идеальным
и очень разбавленным растворам.
Dtз электролитов и концентрированных растворов практически всегда больше,
например, при растворении 1 моля любого неэлектролита изменение температуры
всегда равно 1,86°С, при растворении 1 моля хлористого натрия температура
замерзания понижается на 3,36°С (по расчету 1,86ґ2=3,72), а 1 моля хлористого
кальция примерно -8°С (по расчету 1,86ґ3=5,58). В настоящее время это
объясняется увеличением количества сольватированных ионов за счет диссоциации.
Ионы рассматриваются как отдельные частицы вещества.
Теплота растворения солей складывается из теплот двух процессов гидратации
ионов и растворения. Растворение идет с поглощением тепла (процесс эндотермический),
а гидратация с выделением (процесс экзотермический).
Процесс таяния льда протекает с поглощением тепла. Количество теплоты
плавления льда Qпл = m l , где
l - удельная теплота плавления. для воды l = 1,4 ккал/г или 80 кал/моль.
m - масса льда.
При попадании противоголодедного препарата (соли) на поверхность льда,
его частицы сначала должны раствориться с образованием рассола, который
имеет температуру замерзания ниже температуры замерзания воды. Именно
раствор соли, пока его концентрация такова, что температура его замерзания
ниже температуры плавления льда, растапливает лед. Следовательно, скорость
таяния льда и снега зависит от скорости растворения солей и эвтектической
температуры растворов.
Скорость таяния снега или льда в соляном растворе зависит от диффузии
ионов из концентрированного соляного раствора в менее концентрированный.
Коэффициент диффузии зависит от концентрации соли, подвижности ионов,
температуры.
На рисунке 3 и в таблице 1 приведены справочные данные по растворимости
хлоридов натрия, кальция, калия и магния в зависимости от температуры.
Знаком (*) отмечены концентрации и температуры, соответствующие точке
эвтектики для каждой соли.
Таблица 1. Температура замерзания растворов противогололедных реагентов
|
Концентрация, % |
Температура замерзания, °С |
|||
|
NaCl |
CaCl2 |
MgCl2 |
KCl |
|
|
2 |
-1.2 |
-1,1 |
-0,9 |
|
|
4 |
-2,45 |
-2,3 |
-1,9 |
|
|
6 |
-3,75 |
-3,7 |
-2,8 |
|
|
8 |
-5,11 |
-5,5 |
-3,8 |
|
|
10 |
-6,62 |
-7 |
-7,7 |
-4,8 |
|
12 |
-8,28 |
-9 |
-10,1 |
-5,9 |
|
14 |
-10,00 |
-11 |
-13,4 |
-7,0 |
|
16 |
-11,90 |
-13 |
-17,4 |
-8,2 |
|
18 |
-14,00 |
-17 |
-22,6 |
-9,6 |
|
19.74* |
-10,7* |
|||
|
20 |
-16,30 |
-20 |
-29,0 |
|
|
21* |
-22 |
-33,5* |
||
|
22 |
-19,00 |
-24 |
||
|
23.3* |
-21,20* |
|||
|
24 |
-29 |
|||
|
26 |
-35 |
|||
|
28 |
-43 |
|||
|
29,6* |
-51* |
|||
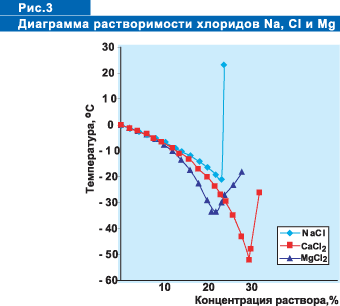
Температура замерзания раствора зависит от его концентрации. Снижение
температуры замерзания идет до достижения раствором точки эвтектики. При
понижении температуры кристаллизуется чистый растворитель, т.е. выделяются
кристаллы льда, следовательно, повышается концентрация соли в растворе
и соответственно понижается температура замерзания, при дальнейшем понижении
температуры снова выделяются кристаллы льда и повышается концентрация
соли. В момент достижения точки эвтектики совместно с кристаллами льда
выделяются кристаллы соли, смесь которых и называется эвтектикой. Хлористый
натрий достигает точки эвтектики при концентрации раствора 23,3 % (-21,2°С),
хлористый кальций - при концентрации 29,5 % (- 51°С), хлорид магния с
концентрацией 21,0 % (-33,5°С), ацетат калия - 50% (- 60°С). При дальнейшем
росте концентрации солей температура кристаллизации повышается, в твердую
фазу выделяются кристаллы соли. В процессе плавления льда растворы хлоридов
разбавляются, концентрация падает. Разбавленные растворы имеют температуру
замерзания выше, чем концентрированные и могут замерзнуть, вызывая дополнительную
скользскость. Поэтому на практике хлористый натрий рационально использовать
при температуре воздуха до -12°С, хлористый кальций - до -34°С
Процесс растворения кристаллов NaCl идет с поглощением тепла и протекает
очень медленно. Кристаллу соли, помещенному на сухую поверхность, первоначально
необходимо накапить тепловую энергию из окружающей среды до момента, пока
на поверхности кристалла не образуется жидкая пленка. Образовавшийся раствор
активизирует растворение оставшейся соли. Под действием собственного веса
и при относительно медленной степени растворимости отдельные частицы хлористого
натрия проникают через слой льда на поверхность дорожного покрытия, что,
в результате, ослабляет связь между дорожным полотном и слоем льда. Рассол,
образующийся вокруг этих частиц, растекаясь по дорожному покрытию, отслаивает
лед от дорожного покрытия. После того как кристалл растворится, он продолжает
накапливать тепловую энергию. Такой процесс с поглощением тепла называется
эндотермической реакцией.
Влага или жидкость, находящаяся на дорожном покрытии, может ускорить
процесс растворения. Жидкость можно распылять непосредственно на дорожное
полотно или добавить ее к соли, до того как она будет внесена на поверхность
льда, т.е. предварительно увлажнить хлористый натрий водой или раствором
хлористого кальция.
Растворение хлористого кальция происходит значительно быстрее, чем растворение
хлористого натрия. Причина в том, что хлористый кальций одновременно гигроскопичен
и растворим в поглощенной из воздуха влаге (CaCl2 при температуре воздуха
от 0°С до -9°С абсорбирует влагу уже .при относительной влажности 42 %
и выше, в то время как NaCl начинает абсорбировать влагу только при относительной
влажности 76 % и выше). Таким образом, хлористый кальций в твердом состоянии
абсорбирует влагу до тех пор, пока не растворится. Рассол будет продолжать
абсорбировать влагу до тех пор, пока не будет достигнуто равновесие между
упругостью паров раствора и упругостью паров воздуха. Если влажность воздуха
повышена, то раствор абсорбирует больше влаги. Если влажность пониженная,
то вода будет испаряться из раствора. Во время растворения хлористого
кальция выделяется большое количество тепла. Такой процесс с выделением
тепла называется экзотермическим. Известно, что с большим выделением тепла
идет процесс образования гидратов (гидротация). Молекула хлористого кальция
присоединяет 6 молекул воды с образованием кристаллогидрата CaCl26H2O.
Растворение кристаллогидрата идет с поглощением тепла. Например, при растворении
1 моля безводного хлористого кальция выделяется 17,4 ккал, при растворении
1 моля шестиводного кристаллогидрата поглощается 4,3 ккал. Следовательно,
теплота гидратации хлористого кальция равна 21,7 ккал, (17,4+4,3=21,7)
Использование хлористого кальция для борьбы с зимней скользкостью ограничивается
температурой ?34°С. Благодаря большой скорости растворения, меньшее количество
хлористого кальция затрачивается в период снегоуборочных работ .
Сравнение термодинамических характеристик противогололедных препаратов
приведено в таблице 2.
Таблица 2. Сравнение термодинамических характеристик противогололедных препаратов.
|
Препарат |
Температура |
|
|
Эвтектическая |
Рабочая |
|
|
Хлористый кальций |
51°С |
34°С |
|
Хлористый натрий |
21,2°С |
9° 12°С |
|
Хлористый калий |
10°С |
4°С |
|
Теплота растворения |
||
|
Экзотермическая реакция |
Эндотермическая реакция |
|
|
Хлористый кальций |
17,4 ккал/моль |
|
|
Хлористый натрий |
1,18 ккал/моль |
|
|
Хлористый калий |
4,28 ккал/моль |
|
Создание оптимальных смесей хлоридов натрия и кальция позволит применять
препарат при более низких температурах, чем хлористый натрий. Хлористый
натрий в смеси с хлористым кальцием будет быстрее растворяться, повысится
плавящая способность.
Приведенные данные показывают, что поиск эффективных противогололедных
материалов надо вести по пути создания эффективных хлоридных смесей, обеспечивающих
безопасность дорожного движения при минимальных расходах.
Однако просто механическое смешение хлоридов натрия и кальция не обеспечит
достаточной эффективности из-за неравномерности распределения солей по
объему смеси. Неоднородность гранулометрического состава приводит к сегрегации
компонентов смеси.
Достигнуть равномерного распределения солей по объему можно лишь при
условии, что кумулятивный процент содержания одинаковых фракций или основное
размерное число гранул и кристаллов не будет отличаться более, чем на
относительных 20 %. Характерный гранулометрический состав хлоридов натрия
и кальция, поставляемых в качестве противогололедного препарата, представлен
в таблице 3.
Таблица 3. Средний гранулометрический состав препаратов, применяемых
против обледенения.
|
Размер, мм |
NaCl |
CaCl2 |
||
|
% |
Кумулятивный % |
% |
Кумулятивный % |
|
|
>5 |
10,4 |
10.4 |
2,8 |
2.8 |
|
>4 |
4,3 |
14.7 |
4,8 |
7.6 |
|
>3,15 |
5,8 |
20.5 |
17,3 |
24.9 |
|
>2,8 |
3,2 |
23.7 |
14,8 |
39.7 |
|
>2,5 |
5,6 |
29.3 |
20,2 |
59.9 |
|
>2,0 |
7,6 |
36.9 |
24,8 |
84.7 |
|
>1,0 |
32,0 |
68.9 |
14,7 |
99.4 |
|
<1,0 |
31,1 |
100.0 |
0,6 |
100.0 |
|
ОРЧ |
1,58 |
2,68 |
||
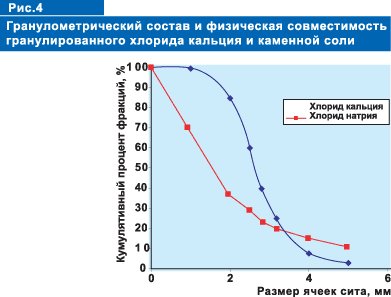 Здесь
ОРЧ - обобщенное размерное число - средняя характеристика гранулометрического
состава.
Здесь
ОРЧ - обобщенное размерное число - средняя характеристика гранулометрического
состава.
Из приведенных данных видно, что разность кумулятивных процентов почти
всех фракций значительно превышает 20% (рис. 3).
Следовательно, при таком гранулометрическом составе получить однородную
физическую смесь двух материалов невозможно. Вследствие сегрегации материал
расслоится, более мелкие кристаллы хлористого натрия будут в нижних слоях
смеси.
АЙСМЕЛТ является реагентом, в котором этот недостаток преодолен.
Технология производства предлагаемого препарата АЙСМЕЛТ для борьбы со
льдом и снегом позволяет получить однородную по всему объему смесь солей,
что обеспечивает эффективную работу препарата.
Когда хлористый кальций и хлористый натрий применяют в качестве препарата для борьбы со снегом и льдом совместно, как сложную смесь, они дополняют друг друга. В случае смешения хлористый кальций, растворяющийся в поглощенной из воздуха влаге, абсорбирует влагу из внешней среды, в результате реакции выделяется тепло, наличие влаги и тепла увеличивает скорость растворения хлористого натрия.
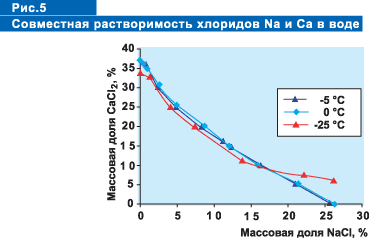 Растворимость
всех реагентов зависит от температуры: чем меньше температура, тем меньше
растворимость. Уменьшение растворимости имеет свой предел, точку, в которой
реагент больше не растворяется, и ниже которой нельзя уменьшить точку
замерзания рассола. На рисунке 4 представлены данные по совместной растворимости
хлористого кальция и хлористого натрия при температуре 0°С, ?5°С и -20°С.
Растворимость
всех реагентов зависит от температуры: чем меньше температура, тем меньше
растворимость. Уменьшение растворимости имеет свой предел, точку, в которой
реагент больше не растворяется, и ниже которой нельзя уменьшить точку
замерзания рассола. На рисунке 4 представлены данные по совместной растворимости
хлористого кальция и хлористого натрия при температуре 0°С, ?5°С и -20°С.
Как видно из приведенных характеристик хлоридов натрия и кальция, сложная смесь этих солей - АЙСМЕЛТ представляет собой препарат максимально отвечающий требованиям, предъявляемым к противогололедным реагентам:
- Понижает температуру замерзания воды и работает при температурах до -20°С.
- За счет экзотермического процесса растворения хлористого кальция возрастает скорость растворения хлористого натрия и таяния льда.
- За счет медленного растворения хлористого натрия, гранулы АЙСМЕЛТ глубже проникают сквозь лед к поверхности дорожного покрытия, а его раствор разрушает сцепление льда и покрытия, что существенно облегчает уборку льда и снега.
- Присутствие кальция снижает количество ионов натрия и соответственно их вредное воздействие на окружающую среду. Уменьшение нормы расхода АЙСМЕЛТ против других реагентов повышает экологическую безопасность.
- Предлагаемая смесь не требует значительных затрат при хранении в отличие
от чистого хлористого кальция.
Реагенты, соответствующие по качеству АЙСМЕЛТ успешно эксплуатируются
в США, Канаде.
Опыт их использования подтверждает, что сложная смесь хлористого кальция
и натрия обеспечивает эффективный оттаивание за счет так называемого синергетического
действия смешиваемых компонентов (Синергизм - такое состояние двух веществ
или двух структур, взаимно помогающих друг другу, при котором совместное
действие обоих веществ производит больший эффект, чем сумма их индивидуальных
(отдельных) воздействий. Годман А., Пейн Е.М.Ф. "Толковый словарь
английской научной лексики". М., "Русский язык", 1987,
стр. 318).
Настоящий раздел отражает материалы опубликованной литературной и электронной
информации по противогололедным продуктам.
К Ваши услугам: группа компаний «НОК-Сервис» «NOK-Service» Co. Ltd
- Наш девиз "Мы умеем дружить" -
Тел. офиса г. Москва: 495 979 5388, Моб. тел.: +7 916 155 7766, +7 901 519 5388, +7 901 545 1818
Представительство за рубежом, Тел.офиса: 8 10 3725 960 7120
Web-Site (проект Народ.ру): Мои проекты-kaluoleg.narod.ru, Антилёд-evroles-msk.narod.ru, Сервисный Центр-planetakar.narod.ru
E-mail: Основной: gdmdelo@yandex.ru, Дополнительные: kaluoleg@yandex.ru kaluoleg@mail.ru mailoleg@umail.ru
